Questões de Concurso
Filtrar
640 Questões de concurso encontradas
Página 88 de 128
Questões por página:
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
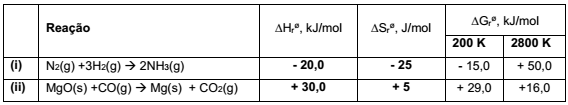
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A retina do olho humano contém dois tipos de células especializadas: os cones e os bastonetes. Nos bastonetes acontece uma transformação química fundamental para a química da visão. Trata-se da conversão do retinol (Vitamina A) em retinal que, na sequência, sofrerá outras transformações.
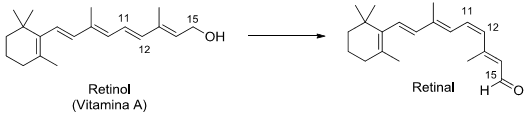
Sobre o tema, considere as seguintes afirmativas:
1. O grupo funcional álcool no retinol é convertido a aldeído no retinal.
2. A ligação dupla entre os carbonos 11 e 12 sofre uma reação de isomerização.
3. A molécula do retinal apresenta um grau de oxidação superior ao do retinol.
4. A molécula do retinol apresenta um centro quiral no carbono 15.
Assinale a alternativa correta.
A reação de hidrólise da acetilcolina, esquematizada abaixo, é fundamental na transmissão de impulsos nervosos nos seres vivos. A reação é promovida pela enzima acetilcolinesterase (AChE).

Considere as seguintes afirmativas sobre o papel de AChE nessa reação:
1. AChE é catalisador da reação.
2. AChE aumenta a energia de ativação da reação.
3. AChE promove caminhos reacionais alternativos.
4. AChE inibe a formação de intermediários.
Assinale a alternativa correta.
O salicilato de metila é um produto natural amplamente utilizado como analgésico tópico para alívio de dores musculares, contusões etc. Esse composto também pode ser obtido por via sintética a partir da reação entre o ácido salicílico e metanol, conforme o esquema abaixo:
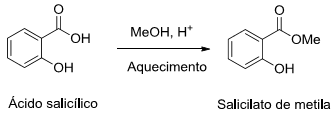
A reação esquematizada é classificada como uma reação de:
O palito de fósforo é um dos artigos mais úteis no nosso cotidiano. Na sua composição, possui fósforo vermelho, enxofre e clorato de potássio. A cabeça de um palito de fósforo pesa aproximadamente 0,05 g. A reação que ocorre na queima da cabeça de fósforo está representada a seguir:
3 P4 + S + 10 KClO3 + O2 → 3 P4O10 + 10 KCl + SO2
O cheiro característico de “fósforo queimado” se deve ao dióxido de enxofre formado.
Dados: No palito de fósforo, os componentes estão em quantidades estequiométricas. M (g mol-1): Cl = 35,5; K = 39; O= 16;P = 31; S = 32.
A massa (em g) de dióxido de enxofre produzido ao queimar uma cabeça de fósforo é aproximadamente: