Questões de Concurso
Filtrar
78 Questões de concurso encontradas
Página 2 de 16
Questões por página:
Questões por página:
A Termoquímica é o ramo da Química que estuda o calor absorvido ou liberado em uma transformação física ou química (reação), pois cada substância armazena uma determinada quantidade de calor, que será alterado quando a substância sofrer alguma transformação. Observe o gráfico a seguir que representa o caminho da reação genérica balanceada.
A2 + B2 → 2 AB
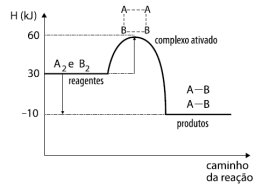
Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
A2 + B2 → 2 AB

Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
São vários os fatores que afetam a velocidade de uma reação química. Observe com atenção as seguintes afirmativas:
I. Ao cortamos a legumes em pequenos pedaços aumentamos a velocidade de cozimento, pois interferimos na energia de ativação da reação.
II. Com o aumento da temperatura, elevamos a agitação térmica das partículas e consequentemente o número de colisões, aumentando a velocidade da reação.
III. A presença de um catalisador altera a entalpia da reação, aumentando a sua velocidade.
IV. Ao mastigarmos mais os alimentos, aumentamos a velocidade da digestão, pois aumentamos a superfície de contato.
Estão corretas as afirmativas:
I. Ao cortamos a legumes em pequenos pedaços aumentamos a velocidade de cozimento, pois interferimos na energia de ativação da reação.
II. Com o aumento da temperatura, elevamos a agitação térmica das partículas e consequentemente o número de colisões, aumentando a velocidade da reação.
III. A presença de um catalisador altera a entalpia da reação, aumentando a sua velocidade.
IV. Ao mastigarmos mais os alimentos, aumentamos a velocidade da digestão, pois aumentamos a superfície de contato.
Estão corretas as afirmativas:
Cinética Química é a parte da Química que os fatores que afetam a velocidade das reações, analisando a rapidez ou a lentidão destas transformações ao longo do tempo, analisando a quantidade de reagentes consumidos ou a quantidade de produtos formados. Tais informações são cruciais para as diversas atividades industriais, para o controle da poluição e até mesmo para tarefas do cotidiano, como o cozimento de alimentos, o armazenamento de medicamentos etc.
Consideremos uma reação química representada pela equação química genérica e não balanceada, a seguir.
A + B → A2B
Escreva a equação de velocidade para esta reação genérica. Faça o balanceamento, utilizando mínimos coeficientes inteiros. E considere que as ordens de reação em relação aos reagentes sejam iguais aos seus respectivos coeficientes estequiométricos (mínimos coeficientes inteiros).
Assinale a alternativa que apresenta a equação de velocidade para esta reação genérica, após seu devido balanceamento.
Consideremos uma reação química representada pela equação química genérica e não balanceada, a seguir.
A + B → A2B
Escreva a equação de velocidade para esta reação genérica. Faça o balanceamento, utilizando mínimos coeficientes inteiros. E considere que as ordens de reação em relação aos reagentes sejam iguais aos seus respectivos coeficientes estequiométricos (mínimos coeficientes inteiros).
Assinale a alternativa que apresenta a equação de velocidade para esta reação genérica, após seu devido balanceamento.
A cinética química estuda os fatores que interferem na velocidade das reações químicas. Em relação ao modo como esses fatores interferem, assinale a alternativa correta.
Uma possibilidade de conversão gás-partícula é a reação direta entre gases resultando em finas partículas sólidas dispersas no ar. Um exemplo é a reação de neutralização de amônia com cloreto de hidrogênio em fase gasosa, que resulta em finas partículas de cloreto de amônio dispersas no ar, formando uma névoa. Essa reação é apresentada em um experimento clássico que ilustra a velocidade de difusão de gases e sua dependência com a massa molar. A reação de formação de NH4Cl (anel branco) ocorre na parte do tubo mais próxima à extremidade onde o HCl é introduzido. Dados: peso molar: H = 1 g/mol, N = 14 g/mol; Cl = 35,5 g/mol. Fonte: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100- 40422017000700824.
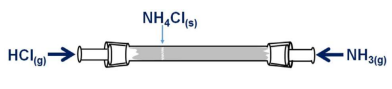
Assim, sendo a velocidade de difusão do cloreto de amônio igual a 27 km/min, pode-se determinar que a velocidade de difusão do HCl no sistema de Graham mostrado acima é

Assim, sendo a velocidade de difusão do cloreto de amônio igual a 27 km/min, pode-se determinar que a velocidade de difusão do HCl no sistema de Graham mostrado acima é