Questões de Concurso
Filtrar
110 Questões de concurso encontradas
Página 14 de 22
Questões por página:
Questões por página:
A possibilidade de estabelecimento de ligação entre dois átomos pode ser de?nida em termos de um parâmetro denominado ordem de ligação (O.L), que pode ser determinada a partir do número de elétrons em orbitais ligantes e antiligantes em diagramas de energia dos orbitais, usando-se a Teoria dos Orbitais Moleculares (TOM). Considerando o parâmetro acima citado, a associação correta entre a molécula e sua ordem de ligação está presente em:
Dentre as exceções à regra do octeto, podemos citar exemplos de moléculas com número ímpar de elétrons (A), moléculas deficientes em elétrons (B) e moléculas com expansão de octeto (C). Assinale a alternativa em que aparecem moléculas dos tipos (A), (B) e (C), respectivamente.
O óxido nitroso, também conhecido como o gás do riso, foi usado como anestésico e hoje é vendido em pequenas cápsulas para preparação de espumas na culinária. Os jovens, hoje, inalam esse gás e sentem um leve torpor e em seguida euforia, embora ainda não se saiba os efeitos colaterais do seu uso prolongado. Acredita-se que pode levar à dependência. O óxido citado no texto pode ser representado pela fórmula
Uma técnica usada em laboratórios químicos é a determinação das fórmulas empíricas (mínimas) pela análise por combustão. Nesse processo, queima-se uma amostra em um tubo por onde passa um fluxo abundante de oxigênio, sendo todo o hidrogênio do composto convertido em água e todo o carbono convertido em dióxido de carbono. O equipamento utilizado é representado pela figura a seguir.

Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1

Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
O fósforo é absorvido pelas plantas na forma de ânions; um desses ânions é o (H2PO4 )- derivado da fluorapatita, encontrada em rochas. A fluorapatita, representada como Ca5 (PO4 )3F, é insolúvel em água e é convertida a di-hidrogenofosfato de cálcio através da reação não balanceada:
Ca5 (PO4)3F (s) + H2SO4 (aq)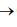 Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g)
Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta equação é
Ca5 (PO4)3F (s) + H2SO4 (aq)
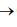 Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g)
Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g) A soma dos menores coeficientes inteiros que balanceiam esta equação é