Questões de Concurso
Filtrar
236 Questões de concurso encontradas
Página 16 de 48
Questões por página:
Questões por página:
A equação iônica balanceada que representa a reação na qual as soluções de nitrato de prata (AgNO3) e o cromiato de sódio (Na2CrO4) para formar um precipitado vermelho é:
As questões ambientais estão em evidência na última década devido ao problema das Mudanças Climáticas e os automóveis são os grandes responsáveis por essas emissões em grandes cidades. Nas cidades, a discussão entre o uso de transporte público é incentivado em detrimento ao uso de automóveis.
Suponha que um automóvel tenha um consumo de 10 km/l, utiliza somente gasolina e leva 1 pessoa somente. Os ônibus possuem um consumo de 4 km/l, levam 40 passageiros e está andando cheio no percurso estudado. Ambos andam em seu percurso,20 km.
Leve em consideração que a fórmula da gasolina seja somente C8H10 e o diesel seja somente C14H30. Massa molar: C8H10=114 g/mol, C14H30= 198 g/mol e CO2=44 g/mol (para facilitar seu cálculo: 8 mol de CO2=352 g e 14 mol CO2=616 g. Densidade da gasolina: 0,7g/ml e diesel: 0,8g/ml.
Com essas informações em mãos, analise as afirmativas a seguir.
I. O automóvel emite mais CO2 que o ônibus. II. O ônibus emite mais CO2 que o automóvel. III. Em termos per capita, o motorista do carro emite mais CO2 que os passageiros do ônibus. IV. Em termos per capita, os passageiros do ônibus emitem mais CO2 que o motorista do carro. V. Com esses dados em mão, mostra-se que políticas públicas são acertadas para diminuição de gás carbônico na atmosfera. VI. Pelos dados calculados, mostra-se que as políticas públicas não fazem diferença nas emissões de gás carbônico.
Estão corretas as afirmativas:
Suponha que um automóvel tenha um consumo de 10 km/l, utiliza somente gasolina e leva 1 pessoa somente. Os ônibus possuem um consumo de 4 km/l, levam 40 passageiros e está andando cheio no percurso estudado. Ambos andam em seu percurso,20 km.
Leve em consideração que a fórmula da gasolina seja somente C8H10 e o diesel seja somente C14H30. Massa molar: C8H10=114 g/mol, C14H30= 198 g/mol e CO2=44 g/mol (para facilitar seu cálculo: 8 mol de CO2=352 g e 14 mol CO2=616 g. Densidade da gasolina: 0,7g/ml e diesel: 0,8g/ml.
Com essas informações em mãos, analise as afirmativas a seguir.
I. O automóvel emite mais CO2 que o ônibus. II. O ônibus emite mais CO2 que o automóvel. III. Em termos per capita, o motorista do carro emite mais CO2 que os passageiros do ônibus. IV. Em termos per capita, os passageiros do ônibus emitem mais CO2 que o motorista do carro. V. Com esses dados em mão, mostra-se que políticas públicas são acertadas para diminuição de gás carbônico na atmosfera. VI. Pelos dados calculados, mostra-se que as políticas públicas não fazem diferença nas emissões de gás carbônico.
Estão corretas as afirmativas:
Uma solução de K2Cr2O7 foi preparada em laboratório:
1) Dissolvendo-se em água 51,0 g em um balão de 250 ml (completado até a marca).2) Em seguida, uma amostra de 2,00 ml desta solução foi transferida para um balão volumétrico de 100 ml e diluída com água até a marca.3) Uma segunda diluição foi feita a partir da solução do item 2, transferindo-se 125 ml para um balão de 250 ml e diluída com água até a marca.
Com esses dados em mãos, analise as afirmativas a seguir.
I. A concentração final da solução na Etapa 1 é de 8 mol.l-1. II. A concentração da solução após a primeira diluição (Etapa 2) é aproximadamente 0,016 mol.l-1. III. A concentração da solução após a segunda diluição (Etapa 3) é aproximadamente 0,008 mol.l-1.
Estão corretas as afirmativas:
1) Dissolvendo-se em água 51,0 g em um balão de 250 ml (completado até a marca).2) Em seguida, uma amostra de 2,00 ml desta solução foi transferida para um balão volumétrico de 100 ml e diluída com água até a marca.3) Uma segunda diluição foi feita a partir da solução do item 2, transferindo-se 125 ml para um balão de 250 ml e diluída com água até a marca.
Com esses dados em mãos, analise as afirmativas a seguir.
I. A concentração final da solução na Etapa 1 é de 8 mol.l-1. II. A concentração da solução após a primeira diluição (Etapa 2) é aproximadamente 0,016 mol.l-1. III. A concentração da solução após a segunda diluição (Etapa 3) é aproximadamente 0,008 mol.l-1.
Estão corretas as afirmativas:
Para uma quantificação química a ser realizada em seu laboratório, o técnico preparou 100 ml de uma solução 50 ng/µl de tetradeceno (CH3(CH2)11CH=CH2) a partir da diluição de solução estoque de 5 µg/µl. A massa molar do tetradeceno é 196 g/mol.
Assinale a alternativa que contém a massa (em gramas) necessária para produzir 500 mL solução estoque.
Assinale a alternativa que contém a massa (em gramas) necessária para produzir 500 mL solução estoque.
Disciplina:
Química
“O metano dura bem menos na atmosfera que o CO2, mas sua capacidade de reter calor é 21 vezes maior; a do N2O é 310 vezes maior que a do CO2. O metano produzido no fundo dos oceanos pela decomposição de material orgânico, principalmente nas crateras, que chega à superfície marinha deve contribuir com algo entre 1% e 5% das emissões globais desse gás para a atmosfera, de acordo com uma estimativa do Instituto Max Planck de Microbiologia Marinha e do Centro de Ciências Ambientais Marinhas (Marum) da Universidade de Bremen, ambos da Alemanha, publicada em 2013 na Nature Geoscience”. (FIORAVANT1,2018).
Considerando a formação do metano, a partir da reação:

Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão: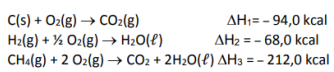
Assinale a alternativa correta.
Considerando a formação do metano, a partir da reação:

Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão:
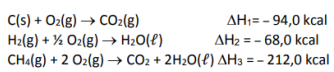
Assinale a alternativa correta.