Questões de Concurso
Filtrar
231 Questões de concurso encontradas
Página 30 de 47
Questões por página:
Questões por página:
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.

A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1

A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4 )6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro. No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4 )6Mo7O24 40 g.L-1 . Nessa solução do reagente combinado as concentrações aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4 )6Mo7O24 são, respectivamente,
Uma técnica usada em laboratórios químicos é a determinação das fórmulas empíricas (mínimas) pela análise por combustão. Nesse processo, queima-se uma amostra em um tubo por onde passa um fluxo abundante de oxigênio, sendo todo o hidrogênio do composto convertido em água e todo o carbono convertido em dióxido de carbono. O equipamento utilizado é representado pela figura a seguir.

Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1

Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
Um técnico preparou em um balão volumétrico 250 mL de uma solução diluída de ácido clorídrico (a 20ºC), pipetando adequadamente 8,4 mL do ácido concentrado 37% m/m de densidade 1,19 g.cm-3 (a 20ºC). A concentração da solução preparada, em mol.L-1 é de, aproximadamente, Dados: Massas molares: H = 1g.mol-1 Cl = 35,5 g.mol–1
O fósforo é absorvido pelas plantas na forma de ânions; um desses ânions é o (H2PO4 )- derivado da fluorapatita, encontrada em rochas. A fluorapatita, representada como Ca5 (PO4 )3F, é insolúvel em água e é convertida a di-hidrogenofosfato de cálcio através da reação não balanceada:
Ca5 (PO4)3F (s) + H2SO4 (aq)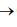 Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g)
Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta equação é
Ca5 (PO4)3F (s) + H2SO4 (aq)
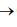 Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g)
Ca(H2PO4 )2 (aq) + CaSO4 (aq) + HF (g) A soma dos menores coeficientes inteiros que balanceiam esta equação é