Questões de Concurso
Filtrar
231 Questões de concurso encontradas
Página 8 de 47
Questões por página:
Questões por página:
Concurso:
Prefeitura Municipal de Rio Claro - S
Disciplina:
Química
O clorato de potássio (KClO3) é conhecido como “Sal de Bertholet”, sua decomposição térmica produz cloreto de potássio(KCl) e gás oxigênio(O2) .
KClO3(s) → KCl(s) + 3/2O2(g)
Essa sua propriedade é frequentemente usada em laboratórios de ensino secundário e superior para produzir gás oxigênio. Nas CNTP, uma amostra de 136 g desse sal com pureza de 90%, em uma decomposição com rendimento de 80%, libera aproximadamente qual volume de gás?
Dados: KClO3 = 122,5u
Volume molar CNTP = 22,7 L
KClO3(s) → KCl(s) + 3/2O2(g)
Essa sua propriedade é frequentemente usada em laboratórios de ensino secundário e superior para produzir gás oxigênio. Nas CNTP, uma amostra de 136 g desse sal com pureza de 90%, em uma decomposição com rendimento de 80%, libera aproximadamente qual volume de gás?
Dados: KClO3 = 122,5u
Volume molar CNTP = 22,7 L
Concurso:
Prefeitura Municipal de Campo Verde - MT
Disciplina:
Química
“Todos os dias, o dia inteiro, ocorrem reações químicas, não só ao nosso redor, mas também no nosso organismo, de tal maneira que se pode dizer que a manutenção da vida depende de uma série de reações. Algumas delas são muito comuns (presentes no nosso cotidiano): a formação da ferrugem, a efervescência produzida por uma antiácido em água e a combustão de um palito de fósforo.”
(Usberco & Salvador in Química Geral)
Em todas as reações químicas, as substâncias denominadas reagentes são transformadas em substâncias diferentes, denominadas produtos. Tais reações são representadas por equações químicas devidamente balanceadas, nas quais a quantidade de átomos de cada elemento participante deve ser igual nos reagentes e nos produtos.
As equações I, II e III a seguir não estão balanceadas:

Após o devido balanceamento estequiométrico das mesmas, a sequência correta, respectivamente em I, II e III, dos coeficientes dos reagentes e produtos necessários será:
(Usberco & Salvador in Química Geral)
Em todas as reações químicas, as substâncias denominadas reagentes são transformadas em substâncias diferentes, denominadas produtos. Tais reações são representadas por equações químicas devidamente balanceadas, nas quais a quantidade de átomos de cada elemento participante deve ser igual nos reagentes e nos produtos.
As equações I, II e III a seguir não estão balanceadas:

Após o devido balanceamento estequiométrico das mesmas, a sequência correta, respectivamente em I, II e III, dos coeficientes dos reagentes e produtos necessários será:
Concurso:
Prefeitura Municipal de Sobral - CE
Disciplina:
Química
mostrar texto associado
Uma das formas da obtenção do gás nitrogênio é através da reação química do sódio com o nitrato de potássio. Sua equação química, não ajustada, é:
Na(s) + KNO3(s) → K2O(s) + Na2O(s) + N2(g).
Assinale a opção que corresponde aos coeficientes do par das substâncias, reagente e produto.
Disciplina:
Química
Um composto possui em sua composição 16,0% de carbono,2,7% de hidrogênio,38,0% de nitrogênio e 43,3% de oxigênio. Para o cálculo das massas de cada átomo da molécula, simulamos uma situação em que temos 100 g do composto e para saber a fórmula empírica do composto, dividimos pela massa molar de cada átomo (C = 12g mol-1, H = 1g mol-1, N = 14g mol-1 e O = 16 g mol-1 ).
Temos então a fórmula empírica como sendo ______. Porém, para sair da fórmula mínima e chegar à fórmula molecular, necessita-se saber que a massa molar desse composto é 220 g mol-1 . Sabendo-se que ______ é o número de unidades mínimas dentro da molécula, sabe-se que a molécula estudada é a ______.
Assinale a alternativa que preencha correta e respectivamente as lacunas.
Temos então a fórmula empírica como sendo ______. Porém, para sair da fórmula mínima e chegar à fórmula molecular, necessita-se saber que a massa molar desse composto é 220 g mol-1 . Sabendo-se que ______ é o número de unidades mínimas dentro da molécula, sabe-se que a molécula estudada é a ______.
Assinale a alternativa que preencha correta e respectivamente as lacunas.
O peróxido de hidrogênio, H2O2, quando em contato com um ferimento na pele, é decomposto pela enzima catalase, liberando água e gás oxigênio, conforme reação a seguir.
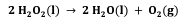
Considerando que 1,3 L de H2O2 (densidade = 1,00 g/mL) se decompõe a 40 °C e pressão de 1,0 atm, assinale a alternativa que apresenta o volume aproximado de gás oxigênio produzido.
Dados:
MM (H2O2) = 34 g/mol.
C = K (Kelvin) – 273
R = 0,082 L.atm/mol.K
