Filtrar
7 Questões de concurso encontradas
Página 1 de 2
Questões por página:
Questões por página:
O óxido de cobre pode ser produzido de diversas maneiras e, devido às suas propriedades únicas, ele encontra aplicações em diversas áreas, tais como, indústria de cerâmica, catalisadores e semicondutores.
Um dos métodos mais comuns envolve a oxidação do metal cobre em presença de ar. São conhecidas a 298K, as seguintes entalpias e entropias a T e P constantes:
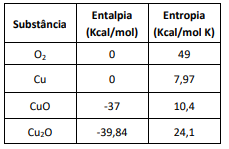
Em relação ao óxido de cobre, assinale a afirmativa correta.
Um dos métodos mais comuns envolve a oxidação do metal cobre em presença de ar. São conhecidas a 298K, as seguintes entalpias e entropias a T e P constantes:

Em relação ao óxido de cobre, assinale a afirmativa correta.
Na etapa do tratamento secundário dos esgotos domésticos, ocorrem vários processos biológicos de tratamento, tanto os de natureza aeróbica quanto os de natureza anaeróbica.
Em relação aos processos de tratamento de lodos ativados e digestores anaeróbicos, assinale a afirmativa correta.
Em relação aos processos de tratamento de lodos ativados e digestores anaeróbicos, assinale a afirmativa correta.
A espontaneidade de uma reação química reversível, a temperatura e a pressão constantes podem ser expressas em termos da energia de Gibbs de reação. Assim, se a energia de Gibbs de reação é:
A respeito dos conceitos de equilíbrio químico, entalpia, entropia e energia livre, assinale a alternativa correta.
O tetranitrato de pentaeritritol (PETN) é um composto de estrutura cristalina amplamente utilizado para fins militares, como explosivo secundário de detonadores. A reação de sua detonação pode ser descrita pela equação a seguir.
C5H8N4O12 (s) → 4 H2O (g) + 3 CO2 (g) + 2 N2 (g) + 2 CO (g)
As entalpias padrão de formação (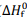 ), a 1 atm e 298 K, são informadas na tabela a seguir.
), a 1 atm e 298 K, são informadas na tabela a seguir.
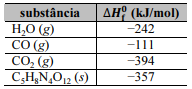
A partir desses dados, é correto concluir que a variação de entalpia para a reação de detonação de PETN, a 1 atm e 298 K, é
C5H8N4O12 (s) → 4 H2O (g) + 3 CO2 (g) + 2 N2 (g) + 2 CO (g)
As entalpias padrão de formação (
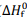 ), a 1 atm e 298 K, são informadas na tabela a seguir.
), a 1 atm e 298 K, são informadas na tabela a seguir. 
A partir desses dados, é correto concluir que a variação de entalpia para a reação de detonação de PETN, a 1 atm e 298 K, é