Questões de Concurso
Filtrar
194 Questões de concurso encontradas
Página 11 de 39
Questões por página:
Questões por página:
Concurso:
Prefeitura de Juiz de Fora - MG
Disciplina:
Química
Assinale a alternativa correta.
Disciplina:
Química
A reação I e II representam reações de oxirredução que ocorrem em pilhas alcalinas.
I.2 MnO2(s) + H2O(ℓ) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H2O(ℓ) + 2 e⁻
As pilhas alcalinas começaram a ser produzidas no Brasil em 1978. A diferença básica entre essa pilha e a de Zn-C é que a primeira emprega célula eletroquímica com materiais ativos de maior grau de pureza. As pilhas alcalinas são mais resistentes a altas temperaturas, oferecem maior segurança contra vazamentos e duram de quatro a dez vezes mais que as Zn-C dependendo do uso. (https://www.scielo.br acesso em 16/04/2023)
Entre as vantagens dessa nova pilha está o fato de não ocorrer a formação de gases durante o processo redox, eliminando-se, portanto, os riscos de explosões. Sabendo-se que o potencial padrão de redução, E°, do zinco e do manganês, nos processos I e II, é -1,25 V e + 0,29 V, respectivamente, calcule a voltagem produzida pela pilha.
I.2 MnO2(s) + H2O(ℓ) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H2O(ℓ) + 2 e⁻
As pilhas alcalinas começaram a ser produzidas no Brasil em 1978. A diferença básica entre essa pilha e a de Zn-C é que a primeira emprega célula eletroquímica com materiais ativos de maior grau de pureza. As pilhas alcalinas são mais resistentes a altas temperaturas, oferecem maior segurança contra vazamentos e duram de quatro a dez vezes mais que as Zn-C dependendo do uso. (https://www.scielo.br acesso em 16/04/2023)
Entre as vantagens dessa nova pilha está o fato de não ocorrer a formação de gases durante o processo redox, eliminando-se, portanto, os riscos de explosões. Sabendo-se que o potencial padrão de redução, E°, do zinco e do manganês, nos processos I e II, é -1,25 V e + 0,29 V, respectivamente, calcule a voltagem produzida pela pilha.
Em uma aula experimental sobre eletrólise, um professor ligou três cubas eletrolíticas (I, II e III) em série, como ilustra a figura a seguir.
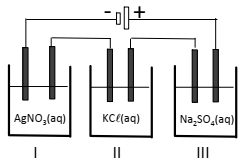
Cada cuba era constituída por um par de eletrodos inertes, continham soluções aquosas de AgNO3, KCl e Na2SO4 de mesma concentração e operaram durante um mesmo período de tempo em iguais condições.
A partir dessas informações, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Na cuba I observa-se formação de gás no cátodo.
( ) Na cuba II o pH da solução aumenta ao longo do processo. ( ) Na cuba III um depósito sólido é formado no ânodo.
As afirmativas são, respectivamente,

Cada cuba era constituída por um par de eletrodos inertes, continham soluções aquosas de AgNO3, KCl e Na2SO4 de mesma concentração e operaram durante um mesmo período de tempo em iguais condições.
A partir dessas informações, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Na cuba I observa-se formação de gás no cátodo.
( ) Na cuba II o pH da solução aumenta ao longo do processo. ( ) Na cuba III um depósito sólido é formado no ânodo.
As afirmativas são, respectivamente,
O cobalto-60, utilizado no tratamento de câncer, pode ser preparado através de um processo denominado transmutação induzida por nêutron. Esse processo ocorre em três etapas e inicia-se a partir do ferro58. Na primeira etapa, o ferro-58 é convertido a ferro-59 pela absorção de um nêutron. A segunda etapa consiste no decaimento beta do ferro-59 para cobalto-59. Na etapa final, o cobalto-59 absorve outro nêutron, sendo convertido a cobalto-60.
A reação global do processo de transmutação descrito pode ser representada po
A reação global do processo de transmutação descrito pode ser representada po
O cloreto de fosforila (POCl3), usado na síntese de ésteres, pode sofrer decomposição segundo a reação abaixo.
2 POCl3(g) → 2 PCl3(g) + O2(g)
Nas condições-padrão a 298 K, a variação de entalpia (ΔH0 ) e a variação de entropia (ΔS 0 ) para esse processo valem, respectivamente,572 kJ e 179 J/K. A partir das informações apresentadas, analise as afirmações a seguir.
I. O processo de decomposição do cloreto de fosforila é endotérmico. II. O processo leva à diminuição da desordem do sistema. III. O processo é não-espontâneo nas condições-padrão.
Está correto apenas o que se afirma em
2 POCl3(g) → 2 PCl3(g) + O2(g)
Nas condições-padrão a 298 K, a variação de entalpia (ΔH0 ) e a variação de entropia (ΔS 0 ) para esse processo valem, respectivamente,572 kJ e 179 J/K. A partir das informações apresentadas, analise as afirmações a seguir.
I. O processo de decomposição do cloreto de fosforila é endotérmico. II. O processo leva à diminuição da desordem do sistema. III. O processo é não-espontâneo nas condições-padrão.
Está correto apenas o que se afirma em