Catalisador é uma substância que aumenta a velocidade de uma reação sem ser consumida, e, em muitos casos, só uma pequena quantidade é necessária. É por isso que pequenas quantidades de clorofluorcarbonetos podem ter um efeito tão devastador na camada de ozônio da estratosfera, eles se decompõem em radicais que catalisam a destruição do ozônio. Um mecanismo proposto para a reação de decomposição do ozônio é: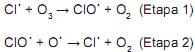
Em relação à atuação do catalisador e o mecanismo acima, julgue os itens a seguir.
I. O radical Cl-é o catalisador da reação, portanto ele altera a cinética da reação, deslocando o equilíbrio no sentido da formação dos produtos.
II. O radical ClO- é o intermediário da reação.
III. A lei da velocidade da reação de decomposição do ozônio é v = k[O3][ O-][ ClO-].
É(São) correta(s) a(s) assertiva(s)