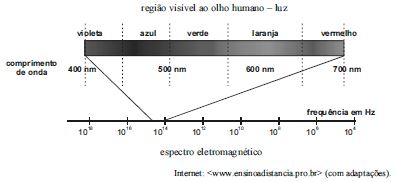
A figura acima ilustra o espectro eletromagnético na região da radiação eletromagnética visível ao olho humano (luz visível). No caso de átomos hidrogenoides (átomos de hidrogênio ou íons atômicos com apenas um elétron), o comprimento de onda do fóton emitido é expresso por 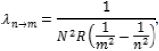 , em que N é o número de prótons no núcleo atômico, m e n são números inteiros estritamente positivos e R = 1,1 × 107 m–1 é a constante de Rydberg.
, em que N é o número de prótons no núcleo atômico, m e n são números inteiros estritamente positivos e R = 1,1 × 107 m–1 é a constante de Rydberg.
Nesse modelo, define-se fluorescência como o fenômeno quântico que ocorre quando um átomo absorve um fóton com comprimento de onda no UV e emite fóton(s) na região da luz visível, devido às transições eletrônicas internas ao átomo.
Com base nessas informações, considerando que um íon He+, no estado fundamental, tenha absorvido um fóton com comprimento de onda no UV, proporcionando uma transição eletrônica entre os níveis eletrônicos n = 1 → n = 4 e, ainda, desconsiderando o recuo do átomo He+, julgue os itens subsecutivos.
No processo descrito, o fóton emitido de maior comprimento de onda situa-se na região do visível entre as cores laranja e vermelho.

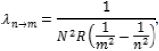 , em que N é o número de prótons no núcleo atômico, m e n são números inteiros estritamente positivos e R = 1,1 × 107 m–1 é a constante de Rydberg.
, em que N é o número de prótons no núcleo atômico, m e n são números inteiros estritamente positivos e R = 1,1 × 107 m–1 é a constante de Rydberg.