Questões de Concurso
Filtrar
630 Questões de concurso encontradas
Página 3 de 126
Questões por página:
Questões por página:
Uma mistura gasosa, formada por 1,00 mol de H2 O(g) e 1,00 mol de CO(g) é colocada num reator de 10,0L, a 520°C. A reação H2 O(g) + CO(g) ↔ CO2 (g) + H2 (g) se processa e verifica-se que, após o
equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520°C, é aproximadamente igual a :
equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520°C, é aproximadamente igual a :
Questão Anulada
A primeira explicação formulada para as ligações existentes nos compostos de coordenação foi a teoria de coordenação de Werner (1893). Esta teoria foi desenvolvida antes da descoberta do elétron e do estabelecimento da teoria eletrônica de valência. Considere as fórmulas de cinco complexos de metais de transição mostradas a seguir:
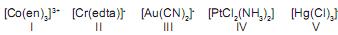
A única opção que apresenta os compostos de coordenação que têm o mesmo número de coordenação é:
Dados: en = etilenodiamina;
edta = etilenodiaminotetracetato
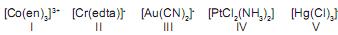
A única opção que apresenta os compostos de coordenação que têm o mesmo número de coordenação é:
Dados: en = etilenodiamina;
edta = etilenodiaminotetracetato
Um dos experimentos mais realizados em aulas de laboratório de química para alunos do ensino médio é descrito a seguir.
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa reação, adiciona-se água e obtém-se uma substância A, que torna vermelho o papel azul de tornassol. Em outro erlenmeyer, faz-se a combustão do magnésio, adiciona-se água e obtém-se uma substância B, que torna azul o papel vermelho de tornassol. Em seguida, promove-se a reação entre A e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa reação, adiciona-se água e obtém-se uma substância A, que torna vermelho o papel azul de tornassol. Em outro erlenmeyer, faz-se a combustão do magnésio, adiciona-se água e obtém-se uma substância B, que torna azul o papel vermelho de tornassol. Em seguida, promove-se a reação entre A e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
Diariamente, inúmeras situações mostram a influência da temperatura na rapidez com que as reações químicas se processam. Por exemplo, a efervescência de um comprimido antiácido é maior em água à temperatura ambiente do que em água gelada. Os alimentos são colocados na geladeira, pois uma diminuição da temperatura faz com que a decomposição dos alimentos por micro-organismos ocorra de forma mais lenta. Em um experimento, a constante de velocidade (k) para a decomposição de primeira ordem de um composto em solução foi determinada a várias temperaturas (T), conforme mostra a tabela a seguir: K 0,00492 0,0216 0,095 0,330 1,15 T (K) 278 288 298 308 318
A energia de ativação para a reação de decomposição pode ser calculada a partir da tabela e seu valor, em kJ.mol -1 , é aproximadamente igual a:
Dados: R= 8,31 J.mol -1. k-1 , ln 4,4 = 1,48; ln 3,5 = 1,25
A energia de ativação para a reação de decomposição pode ser calculada a partir da tabela e seu valor, em kJ.mol -1 , é aproximadamente igual a:
Dados: R= 8,31 J.mol -1. k-1 , ln 4,4 = 1,48; ln 3,5 = 1,25
O álcool benzílico (ou fenilmetanol) é um álcool aromático líquido. É utilizado como componente de fragrâncias e aromas, como preservante para produtos oftálmicos, injetáveis e orais, sendo também usado como solvente e como um produto químico intermediário para reações orgânicas. A reação do álcool benzílico com uma solução aquosa básica de permanganato de potássio produz um composto A que, após purificação, reage com excesso de etanol, sob catálise ácida, formando um produto orgânico B, também de aplicação industrial, cujo nome é: