Questões de Concurso
Filtrar
60 Questões de concurso encontradas
Página 6 de 12
Questões por página:
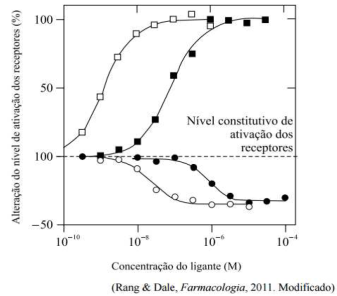
Com base na interação fármaco-receptor sabemos que a ocupação de um receptor por uma molécula de um fármaco pode ou não resultar na ativação desse receptor. Com base nessas interações, julgue as afirmativas e marque a alternativa CORRETA.
I- O Antagonismo competitivo reversível é aquele, no qual, na presença do antagonista, a curva do log da concentração x efeito do agonista é deslocada para esquerda, sem alteração na inclinação ou no efeito máximo, sendo a extensão do deslocamento uma medida da razão de dose.
II- O Antagonista competitivo de não equilíbrio, ocorre quando o antagonista se dissocia dos receptores, tendo como resultado a não alteração da ocupação do antagonista quando o agonista é aplicado.
III- O aumento da concentração do agonista supera o efeito do antagonista reversível, de modo que a resposta não se altera enquanto o efeito de um antagonista não competitivo é insuperável, e a ocupação total pelo agonista não pode ser atingida.
IV- O antagonismo competitivo irreversível ocorre com fármacos que possuem grupos reativos que formam ligações covalentes com o receptor.
V- Além do sítio de ligação ao agonista, no qual os antagonistas competitivos se ligam, as proteínas receptores possuem muitos outros sítios de ligação através dos quais fármacos podem influenciar a função do receptor de várias maneiras, aumentando ou diminuindo a afinidade dos agonistas pelo sítio de ligação do agonista ou modificando a eficácia.
A técnica de western blotting (Towbin et al.1979; Burnette 1981; Towbin and Gordon 1984) também pode ser denominada protei n immunoblot e consiste na detecção de proteínas específicas em amostras de lisados celulares ou amostras de tecidos. Com base nessa técnica, julgue as afirmativas e marque a alternativa CORRETA.
I- Os passos para a elaboração dessa técnica podem ser resumidos em cinco etapas: (1) extração e quantificação das proteínas; (2) fracionamento das proteínas da amostra em um gel de poliacrilamida; (3) transferências dessas proteínas para uma membrana; (4) incubação da membrana com um anticorpo para detectar a proteína específica a ser analisada; e (5) revelação dessa membrana para análise dos dados.
II- Diversos métodos espectroscópicos são utilizados para quantificar proteínas em uma solução. O ensaio de Bradford é o mais utilizado e apresenta diversas vantagens em relação aos demais, como a rapidez, a não exigência de aquecimento e a alta sensibilidade para baixas concentrações de proteínas. O método de Bradford se baseia na mudança de cor do corante Coomassie Blue G-250, em solução ácida (cor azulada) para cor avermelhada na presença de proteínas. As interações hidrofóbicas e iônicas estabilizam o complexo proteína-corante.
III- Para separar as proteínas de uma amostra homogênea, a técnica mais utilizada é a eletroforese em gel de SDS-poliacrilamida (SDS-PAGE). Inicialmente prepara-se o gel de SDS-poliacrilamida, que será uma matriz inerte através da qual as proteínas poderão migrar. O gel é preparado pela polimerização de monômeros de acrilamida e o tamanho dos poros do gel pode ser ajustado variando a concentração da acrilamida adicionada para retardar a migração da sua proteína de interesse. As proteínas podem possuir cargas positivas ou negativas, dependendo das cargas dos aminoácidos que as compõem.
IV- Para visualizar uma proteína de interesse, é utilizado um anticorpo específico que vai reagir com um epítopo da proteína, formando um complexo anticorpoantígeno. Esse anticorpo é denominado anticorpo primário, que pode ser policlonal (reconhece mais de um epítopo) ou monoclonal (reconhece apenas um epítopo da proteína de interesse) e é geralmente obtido apenas em camundongo ou em coelho.