Questões do concurso:
UNEMAT - MT - 2024 - CESGRANRIO - 2024 - UNEMAT - Químico
limpar filtros
60 Questões de concurso encontradas
Página 2 de 12
Questões por página:
Questões por página:
Niels Bohr realizou cálculos de energias associadas às órbitas permitidas para o elétron no átomo de hidrogênio isolado. As energias calculadas ajustam-se à fórmula
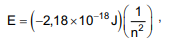
onde E é a energia da órbita permitida para um elétron no átomo de hidrogênio, em Joule, e n representa o número quântico principal que assume valores inteiros de 1,2,3, ... ∞ .
Dessa forma, com base nesse modelo atômico, para Bohr a(o)
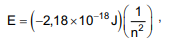
onde E é a energia da órbita permitida para um elétron no átomo de hidrogênio, em Joule, e n representa o número quântico principal que assume valores inteiros de 1,2,3, ... ∞ .
Dessa forma, com base nesse modelo atômico, para Bohr a(o)
Numa curva de titulação volumétrica tradicional muitas vezes é difícil visualizar o volume final da titulação. Uma das estratégias é tratar os dados da titulação usando o método de Gram.
Nessa abordagem, no caso de uma titulação redox monitorada com um eletrodo combinado, graficamente obtém-se a(o)
Nessa abordagem, no caso de uma titulação redox monitorada com um eletrodo combinado, graficamente obtém-se a(o)
Questão Anulada
Na titulação argentométrica de 50,00 mL de solução de NaCl (2,0 × 10-2 mol L-1 ), usou-se uma solução padronizada de AgNO3 (4,0 × 10-2 mol L-1 ) como representado na reação iônica a seguir.
Cl - (aq) + Ag+ (aq) → AgCl (s)
Após o ponto de equivalência, continuou-se adicionando 10,00 mL de excesso do agente titulante até que a concentração de íons em solução (ver equação a seguir) atingisse o equilíbrio.
AgCl (s) ? Cl - (aq) + Ag+ (aq)
A concentração de Cl - na solução, em mol L-1, será aproximadamente de
Cl - (aq) + Ag+ (aq) → AgCl (s)
Após o ponto de equivalência, continuou-se adicionando 10,00 mL de excesso do agente titulante até que a concentração de íons em solução (ver equação a seguir) atingisse o equilíbrio.
AgCl (s) ? Cl - (aq) + Ag+ (aq)
A concentração de Cl - na solução, em mol L-1, será aproximadamente de
Um analista obteve os espectros de absorção molecular das substâncias: R-C=C-R, R-C=C-C=C-R e R-C=C-C=C-C=C-R, onde R é um grupo comum às três substâncias. As substâncias estavam dissolvidas no mesmo solvente e na mesma concentração em mol L-1 .
Em termos comparativos, em relação às outras duas substâncias, a banda espectral de
Em termos comparativos, em relação às outras duas substâncias, a banda espectral de
Um sistema coulométrico foi usado para a determinação de concentração hidrogeniônica (H+) de uma solução. Este consistia de duas meias-células, cada uma contendo um eletrodo de Pt e um eletrólito forte dissolvido, sendo as duas meias- -células conectadas por ponte salina de KNO3 . Ao se acionar o sistema, no eletrodo de trabalho se formou gás O2, e no contra-eletrodo, o gás H2 . Adicionou-se vermelho de bromofenol à meia-célula que continha o eletrodo de trabalho, que indicou, pela mudança de cor, o momento em que a amostra atingiu pH neutro. Nesse sistema, realizou-se uma análise de 100,00 mL de solução de pH 4,00, aplicando-se corrente constante de 50,0 mA. Considerando-se esse sistema, verifica-se que
Dado F = 96.500 C mol-1
Dado F = 96.500 C mol-1