Questões de Concurso
Filtrar
2.493 Questões de concurso encontradas
Página 192 de 499
Questões por página:
Questões por página:
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos. K( s) + H2O( l) → KOH( aq) + H2(g) Ba(s) + O2(g) → BaO(s)
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos. K( s) + H2O( l) → KOH( aq) + H2(g) Ba(s) + O2(g) → BaO(s)
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos. K( s) + H2O( l) → KOH( aq) + H2(g) Ba(s) + O2(g) → BaO(s)
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
K( s) + H2O( l) → KOH( aq) + H2(g)
Ba(s) + O2(g) → BaO(s)
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
No material base que compõe o pó químico dos extintores utilizados contra incêndios classe D, a espécie química cloro apresenta a configuração eletrônica 1s 2 2s 2 2p6 3s 2 3p5, conforme o diagrama de Linus Pauling.
K( s) + H2O( l) → KOH( aq) + H2(g)
Ba(s) + O2(g) → BaO(s)
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
No material base que compõe o pó químico dos extintores utilizados contra incêndios classe D, a espécie química cloro apresenta a configuração eletrônica 1s 2 2s 2 2p6 3s 2 3p5, conforme o diagrama de Linus Pauling.
mostrar texto associado
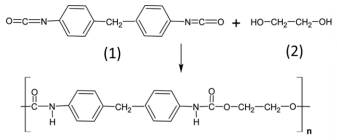
Com base nas informações apresentadas, julgue o item que se seguem, considerando que MH = 1,00 g/mol, MC = 12,00 g/mol, MN = 14,00 g/mol e MO = 16,00 g/mol.
A oxidação total do composto 2 produz o seguinte composto.
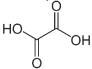
A oxidação total do composto 2 produz o seguinte composto.