Questões de Concurso
Filtrar
2.583 Questões de concurso encontradas
Página 211 de 517
Questões por página:
Questões por página:
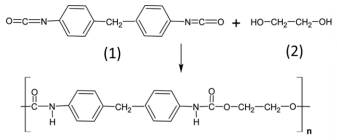
mostrar texto associado
Com base nas informações apresentadas, julgue o item que se seguem, considerando que MH = 1,00 g/mol, MC = 12,00 g/mol, MN = 14,00 g/mol e MO = 16,00 g/mol.
A massa molar do composto 1 é menor que 245,0 g/mol.
A massa molar do composto 1 é menor que 245,0 g/mol.
mostrar texto associado
Com base nas informações apresentadas, julgue o item que se seguem, considerando que MH = 1,00 g/mol, MC = 12,00 g/mol, MN = 14,00 g/mol e MO = 16,00 g/mol.
O composto 1 apresenta duas aminas terciárias.
O composto 1 apresenta duas aminas terciárias.
mostrar texto associado
Com base nas informações apresentadas, julgue o item que se seguem, considerando que MH = 1,00 g/mol, MC = 12,00 g/mol, MN = 14,00 g/mol e MO = 16,00 g/mol.
O nome do composto 2 é etano-1,2-diol.
O nome do composto 2 é etano-1,2-diol.
mostrar texto associado
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Na reação de dupla troca do (NH4)2SO4 com o CaCl2, um dos compostos gerados é o sulfato de cálcio, de fórmula CaSO4.
Na reação de dupla troca do (NH4)2SO4 com o CaCl2, um dos compostos gerados é o sulfato de cálcio, de fórmula CaSO4.
mostrar texto associado
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Considere que a obtenção do NH4H2PO4 se dê pela reação do ácido fosfórico (H3PO4) com a amônia (NH3) em uma reação com 100% de rendimento. Nesse caso, para a obtenção de 120 kg de NH4H2PO4, são necessários menos de 100 kg de ácido fosfórico.