Questões de Concurso
Filtrar
2.604 Questões de concurso encontradas
Página 83 de 521
Questões por página:
Questões por página:
Concurso:
Instituto Federal Pará
Disciplina:
Química
JM, técnico de laboratório, foi contratado por certa empresa siderúrgica para monitorar a produção de ferro a partir de minérios de ferro. O profissional observou a reação de redução do Fe2O3 pelo CO para produzir ferro metálico e CO2. Ao gerar o relatório detalhado de suas observações, JM precisou expressar a reação química ocorrida no referido processo da siderúrgica. A equação química não balanceada é apresentada a seguir:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Após o balanceamento, a somatória dos menores coeficientes estequiométricos (números inteiros) para a reação química apresentada será de:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Após o balanceamento, a somatória dos menores coeficientes estequiométricos (números inteiros) para a reação química apresentada será de:
Concurso:
Instituto Federal Pará
Disciplina:
Química
Ao preparar os materiais para a aula de reações químicas, o técnico de laboratório observou no roteiro a imagem e a descrição a seguir: 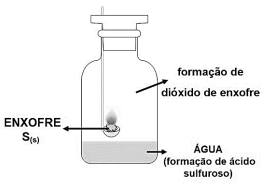
Certa quantidade de enxofre é inserida no dispositivo de combustão e a chama é iniciada no bico de Bunsen. Então, ainda com a chama acesa, o dispositivo é inserido em um frasco hermeticamente fechado e o dióxido de enxofre formado fica confinado no recipiente. Este gás, por sua vez, reage com a água contida no fundo do frasco, formando uma solução de ácido sulfuroso. Considerando todas as informações apresentadas e a imagem, a reação que expressa corretamente a formação do ácido sulfuroso é:

Certa quantidade de enxofre é inserida no dispositivo de combustão e a chama é iniciada no bico de Bunsen. Então, ainda com a chama acesa, o dispositivo é inserido em um frasco hermeticamente fechado e o dióxido de enxofre formado fica confinado no recipiente. Este gás, por sua vez, reage com a água contida no fundo do frasco, formando uma solução de ácido sulfuroso. Considerando todas as informações apresentadas e a imagem, a reação que expressa corretamente a formação do ácido sulfuroso é:
Concurso:
Instituto Federal Pará
Disciplina:
Química
A Tomografia por Emissão de Pósitrons (conhecida pela sigla inglesa PET) é uma técnica de cintilografia que utiliza radionuclídeos, os quais liberam partículas chamadas pósitrons em vez de fótons de alta energia, como na maioria dos outros tipos de cintilografia. O objetivo da PET é produzir imagens do interior do corpo para diagnosticar doenças como o câncer. Descreve corretamente um pósitron:
Concurso:
Prefeitura Municipal de Cerquilho - SP
Disciplina:
Química
Para preparar 500 mL de uma solução de ácido clorídrico, HCl,6,0 mol/L, um funcionário de um laboratório químico empregou uma solução de ácido clorídrico de concentração 12 mol/L.
O volume do ácido clorídrico 12 mol/L empregado para a preparação da solução 6,0 mol/L foi
Concurso:
Prefeitura Municipal de Cerquilho - SP
Disciplina:
Química
Um funcionário de laboratório de análises precisa preparar 1 L de uma solução de hidróxido de sódio, NaOH, massa molar 40 g/mol, com concentração 0,5 mol/L.
Assinale a alternativa que apresenta a massa de hidróxido de sódio que deve ser empregada para o reparo dessa solução.