60 Questões de concurso encontradas
Página 8 de 12
Questões por página:
Considere a seguinte reação entre as espécies A e B que dá origem ao composto A2B3, todos no estado gasoso
2A(g) + 3B(g) → A2B3(g)
De um conjunto de experimentos foram coletados dados e estes, organizados na seguinte tabela:
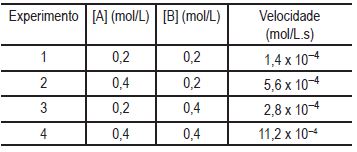
Considerando os resultados dos quatro experimentos, a expressão da velocidade (v) dessa reação é
Um recipiente contém 0,1 mol de ácido acético e 0,1 mol de acetato de sódio em 1,0 L de solução. No meio aquoso, essas duas substâncias estabelecem o seguinte equilíbrio: 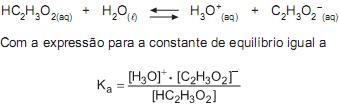
Princípio de Le Chatelier: “Se um sistema em equilíbrio é submetido a uma perturbação, o sistema se ajusta de modo a contrapor os efeitos da perturbação e alcançar uma nova situação de equilíbrio”.
Com base nesse princípio, na expressão da constante Ka, e considerando temperatura e força iônica constantes, após a adição de 1 mL de solução aquosa de NaOH 1 mol/L à solução contendo acetato de sódio e ácido acético, uma nova situação de equilíbrio seria alcançada após o(a)
H 2(g)+ I 2(g) ⇆ 2HI (g)
O equilíbrio, nessa temperatura, foi atingido com as concentrações de H 2(g) , I 2(g)e HI(g)iguais a 0,0040 mol/L, 0,0040 mol/L e 0,028 mol/L, respectivamente.
A constante de equilíbrio, nessa temperatura, em função das concentrações em quantidade de matéria (mol/L) é igual a
Na2 SO4(aq)+ BaCl 2(aq)→ BaSO 4(s)+ 2NaCl (aq)
A quantidade máxima de sulfato de bário que se forma é, aproximadamente, de
A porcentagem de CaCO3 presente nesse calcário é