Questões de Concurso
Filtrar
2.557 Questões de concurso encontradas
Página 340 de 512
Questões por página:
Questões por página:
A morfina é um alcalóide presente no ópio. É facilmente absorvida pelas mucosas, sendo lenta a sua absorção pelo trato gastrointestinal, em função de seu elevado pKa = 9,85. Sabendo que um teste para tal substância se processa em meio tamponado de pH = 8, identifique dentre as alternativas a espécie predominante no meio reacional.
Uma estrutura com dois estereocentros nem sempre tem quatro estereoisômeros possíveis. Às vezes apenas três. Isto ocorre porque algumas moléculas são aquirais embora contenham estereocentros. Observe esta afirmativa nas fórmulas estereoquímicas para o 2,3-dibromobutano apresentadas na Figura 69.

A seguir estão fórmulas para três compostos, escritas em conformações não-eclipsadas. Indique a alternativa que apresenta, respectivamente, qual estrutura (A, B, C e D) cada fórmula representa.


A seguir estão fórmulas para três compostos, escritas em conformações não-eclipsadas. Indique a alternativa que apresenta, respectivamente, qual estrutura (A, B, C e D) cada fórmula representa.

Questão Anulada
Um grande problema ambiental é a liberação excessiva de dióxido de carbono na atmosfera, ocasionada em grande parte pela queima de combustíveis. A queima de carbono produz dióxido de carbono. Portanto, uma característica importante, ao se escolher um combustível, é analisar seu calor de combustão (• H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.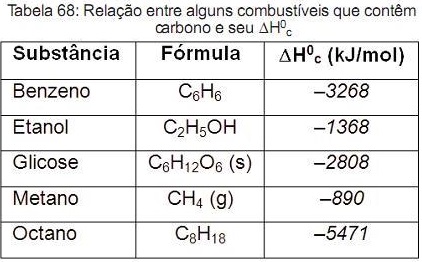
Neste contexto, indique qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida.
O ácido etilenodiaminotetracético (EDTA), um composto muito usado em análise quantitativa, forma complexo estáveis com a maioria dos íons metálicos na proporção 1:1. Indique a alternativa, dentre as opções, que apresenta o principal motivo da aplicação prática do EDTA como agente complexantes para uma grande maioria de metais.
Em 2003, um erro na indústria farmacêutica provocou a intoxicação em dezenas de pessoas, pois o medicamento deveria conter somente BaSO4, mas, quase 15% da massa do Celobar comercializado foi de BaCO3. Este crime ocorreu devido ao BaCO3 ser solúvel em água liberou o íon Ba2+ no meio. Ao adicionar BaSO4 em água, não ocorre dissolução. Marque a alternativa que apresenta os sais, assim como o BaSO4, pouco solúveis em água.