Questões de Concurso
Filtrar
2.547 Questões de concurso encontradas
Página 458 de 510
Questões por página:
Um fluido incompressível, com peso específico 9.000 N/m3 , escoa em uma tubulação de diâmetro uniforme desde a cota 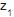 = -5 m até a cota
= -5 m até a cota = 10 m, onde a pressão é atmosférica. Se a perda de carga associada ao escoamento é de 3 m de coluna do referido fluido, a pressão manométrica na tubulação na cota
= 10 m, onde a pressão é atmosférica. Se a perda de carga associada ao escoamento é de 3 m de coluna do referido fluido, a pressão manométrica na tubulação na cota  é
é
Um fluido newtoniano incompressível, com massa específica ρ, escoa com vazão mássica W em uma tubulação de diâmetro D e comprimento equivalente L, num local onde a aceleração da gravidade é g. Se o fator de atrito é f, a perda de carga (energia por unidade de peso de fluido) associada é
Um cubo (hexaedro regular) sólido de aresta L é formado colando-se as faces L x L de dois prismas retos com arestas L x L x L / 2. Os prismas têm massas específicas ρ1 e ρ2. O cubo flutua na configuração mais estável e em repouso na superfície livre de um líquido com massa específica ρ3 em equilíbrio estático. Acima do líquido existe ar cujos efeitos podem ser desprezados. Sabendo-se que ρ1 < ρ2 < ρ3, e que o centro geométrico do cubo está situado a uma distância Z abaixo da interface líquido – ar, o valor de Z é
 , sendo
, sendo . Se 70% do volume da esfera está submerso no líquido mais denso, a massa específica da esfera é
. Se 70% do volume da esfera está submerso no líquido mais denso, a massa específica da esfera é