Questões de Concurso
Filtrar
386.569 Questões de concurso encontradas
Página 153 de 77.314
Questões por página:
Consideremos uma reação química representada pela equação química genérica e não balanceada, a seguir.
A + B → A2B
Escreva a equação de velocidade para esta reação genérica. Faça o balanceamento, utilizando mínimos coeficientes inteiros. E considere que as ordens de reação em relação aos reagentes sejam iguais aos seus respectivos coeficientes estequiométricos (mínimos coeficientes inteiros).
Assinale a alternativa que apresenta a equação de velocidade para esta reação genérica, após seu devido balanceamento.
Adaptado. Sala BioQuímica: Controle (e descontrole) do pH sanguíneo (salabioquimica.blogspot.com). Acesso em 25 de Julho de 2021.
A seguir, temos as reações de conversão do gás carbônico (CO2) em bicarbonato (HCO3 - ).
CO2 (g) + H2O (l) ↔ H2CO3 (aq) H2CO3 (aq) ↔ HCO3 – (aq) + H+ (aq)
Elas são a base para entendermos o comportamento desse sistema tamponado do sangue nos dois ambientes diferentes: no tecido muscular e nos alvéolos. Assim, de acordo com as características do controle de pH do sistema sanguíneo, assinale a alternativa correta.
Adaptado. CÉLULA A COMBUSTÍVEL, COMO FUNCIONA – Autoentusiastas. Acesso em 20 de Julho de 2021.
A seguir, temos um esquema da célula a combustível de gás hidrogênio.
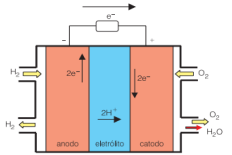
Esquema da célula a combustível de gás hidrogênio. Disponível em: www.usp.br/portalbiossistemas/?p=4316#:~:text=Em outras palavras%2C nessa célula a combustível a, célula a combustível é%3A H2 %2B ½O2→ H2O. Acesso em 20 de Julho de 2021.
A reação global balanceada da célula a combustível de gás hidrogênio é:
H2 (g) + ½O2 (g) → H2O (g)
Analisando o esquema da célula a combustível de gás hidrogênio (acima) e sua reação global balanceada, assinale a alternativa correta.
Os polímeros são grandes moléculas que apresentam unidades que se repetem, chamadas monômeros. Tais moléculas podem ser encontradas na natureza ou produzidas em laboratório, através de reações de polimerização. Uma das principais e mais importantes características dos polímeros é a resistência mecânica. E segundo ela, os polímeros podem ser divididos em termoplásticos, termoendurecíveis (termofixos) e elastômeros (borrachas). Um exemplo de plástico termofixo são as resinas epóxi. Elas são base para diversas aplicações e produtos industriais, sendo empregadas na fabricação de tintas, materiais compósitos, adesivos de engenharia de alta performance, fabricação de aviões, automóveis, bicicletas, barcos, snowboards, colagem de madeiras, metais, vidros e pedras, sob condições ambientais de temperatura e pressão. Além da fabricação de circuitos eletroeletrônicos, pois são protetores de componentes de pequenos circuitos, como resistores, transistores e capacitores.
Adaptado. g5.pdf (unicamp.br). Acesso em 25 de Julho de 2021.
A seguir, apresentamos a sua fórmula estrutural.
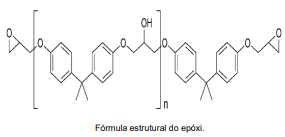
Analisando a fórmula estrutural do epóxi, assinale a alternativa correta.
Observe a tabela a seguir. Temos quatro reações (I, II, III e IV) e seus respectivos produtos.
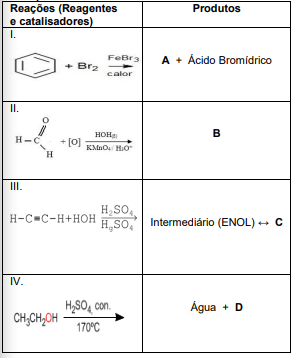
Analise as reações (I, II, III e IV) representadas na tabela acima. Observe suas características e sua classificação. Assinale a alternativa que relaciona corretamente a reação e seu respectivo produto (A, B, C e D), respectivamente.