105 Questões de concurso encontradas
Página 3 de 21
Questões por página:
Dado: Kps (CaF2 ) = 3,9 x 10-11
A reação de transformação do dióxido de carbono, representada pela equação abaixo, é reversível. Com relação a essa reação em equilíbrio, julgue os itens a seguir.
I. A constante de equilíbrio dessa reação expressa em termos de concentração é Kc = [CO]2 /[CO2].[C]
II. Segundo o princípio de Le Chatelier, se for adicionado mais C(s) no meio reacional, o equilíbrio irá se deslocar no sentido da formação de CO.
III. O aumento da temperatura favorece a formação de CO.
IV. A adição de um catalisador não infl uencia no estado de equilíbrio dessa reação, pois o catalisador aumenta simultaneamente as velocidades das reações direta e inversa, diminuindo as energias de ativação de ambas as reações.
É(São) correta(s) apenas a(s) assertativa(s)
O cloreto de carbonila, conhecido como fosgênio, é um gás tóxico e corrosivo de fórmula COCl 2 . Atualmente é usado na indústria como agente de cloração, porém foi usado na I Guerra Mundial como gás de guerra, do tipo sufocante. Para a reação entre o monóxido de carbono e cloro para produzir o cloreto de carbonila, assinale a expressão que indica a lei de velocidade e o valor da constante de velocidade, respectivamente.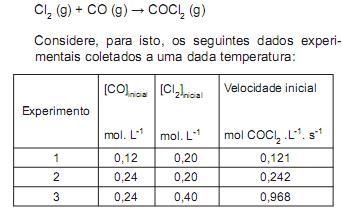
Catalisador é uma substância que aumenta a velocidade de uma reação sem ser consumida, e, em muitos casos, só uma pequena quantidade é necessária. É por isso que pequenas quantidades de clorofluorcarbonetos podem ter um efeito tão devastador na camada de ozônio da estratosfera, eles se decompõem em radicais que catalisam a destruição do ozônio. Um mecanismo proposto para a reação de decomposição do ozônio é: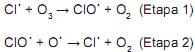
Em relação à atuação do catalisador e o mecanismo acima, julgue os itens a seguir.
I. O radical Cl-é o catalisador da reação, portanto ele altera a cinética da reação, deslocando o equilíbrio no sentido da formação dos produtos.
II. O radical ClO- é o intermediário da reação.
III. A lei da velocidade da reação de decomposição do ozônio é v = k[O3][ O-][ ClO-].
É(São) correta(s) a(s) assertiva(s)
